L’I2MC
Centre de recherche dédié à l’étude de la physiopathologie des maladies métaboliques, cardiovasculaires et rénales.

Équipes
Chercheurs
Plateaux techniques

Publications par an
Actualités
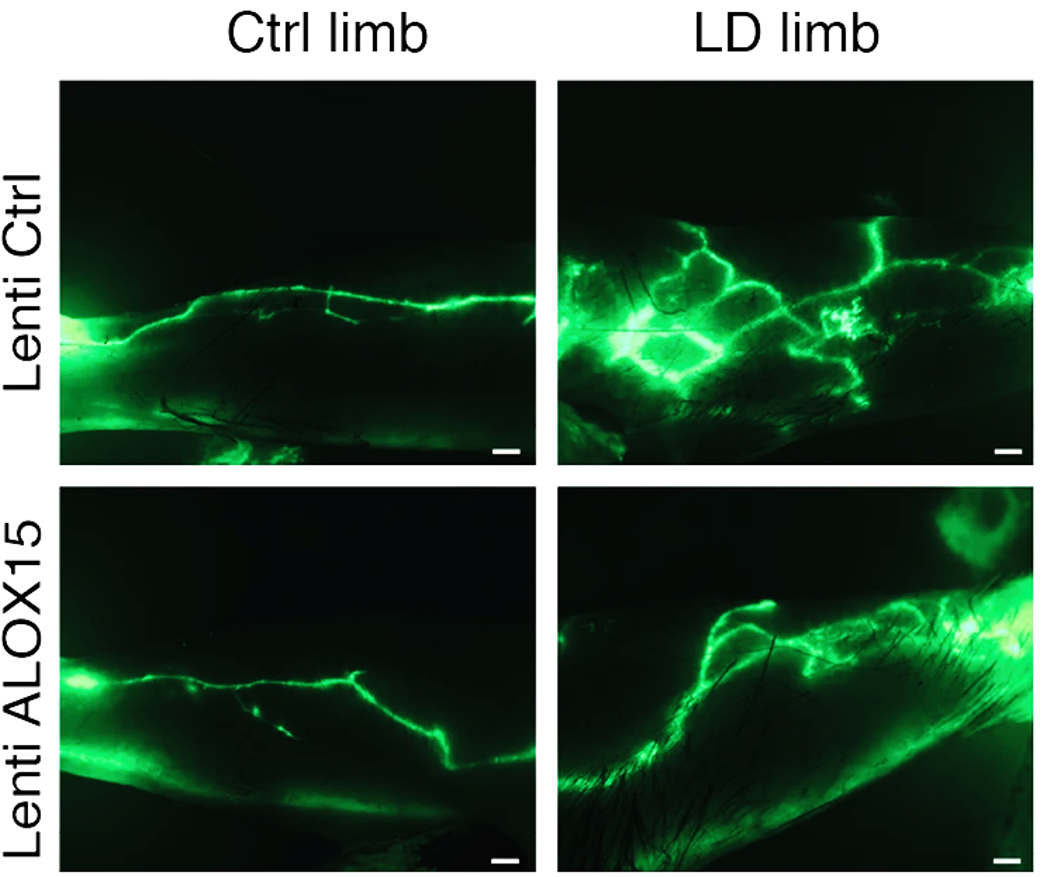
Actualités générales
Publications/Prix
En Interne
Axes
De recherches
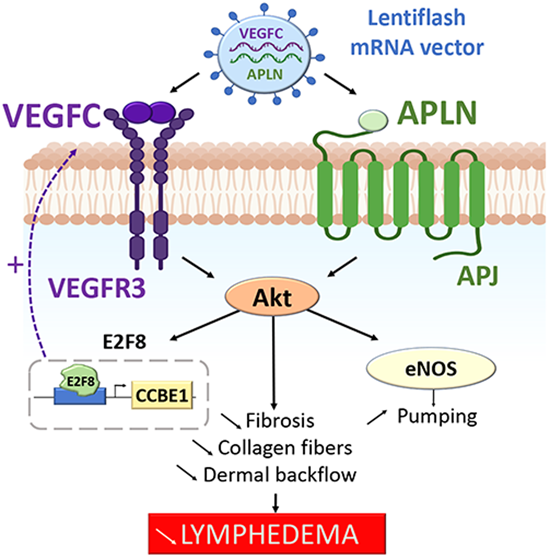
MALADIES MÉTABOLIQUES
Obésité, diabète, dyslipidémie, stéatose hépatique, dysbiose intestinale


MALADIES CARDIOVASCULAIRES ET RÉNALES
Maladies des vaisseaux, athérosclérose, thrombose, insuffisances cardiaque et rénale
Plateaux
Techniques


Inserm/UPS UMR 1297 - I2MC Institut des Maladies Métaboliques et Cardiovasculaires
1 avenue Jean Poulhès - BP 84225 - 31432 Toulouse Cedex 4
Tél. : 05 61 32 56 00
Horaires
Du lundi au vendredi
8h30 - 12h30 / 13h45 -16h45