équipe L. Martinez
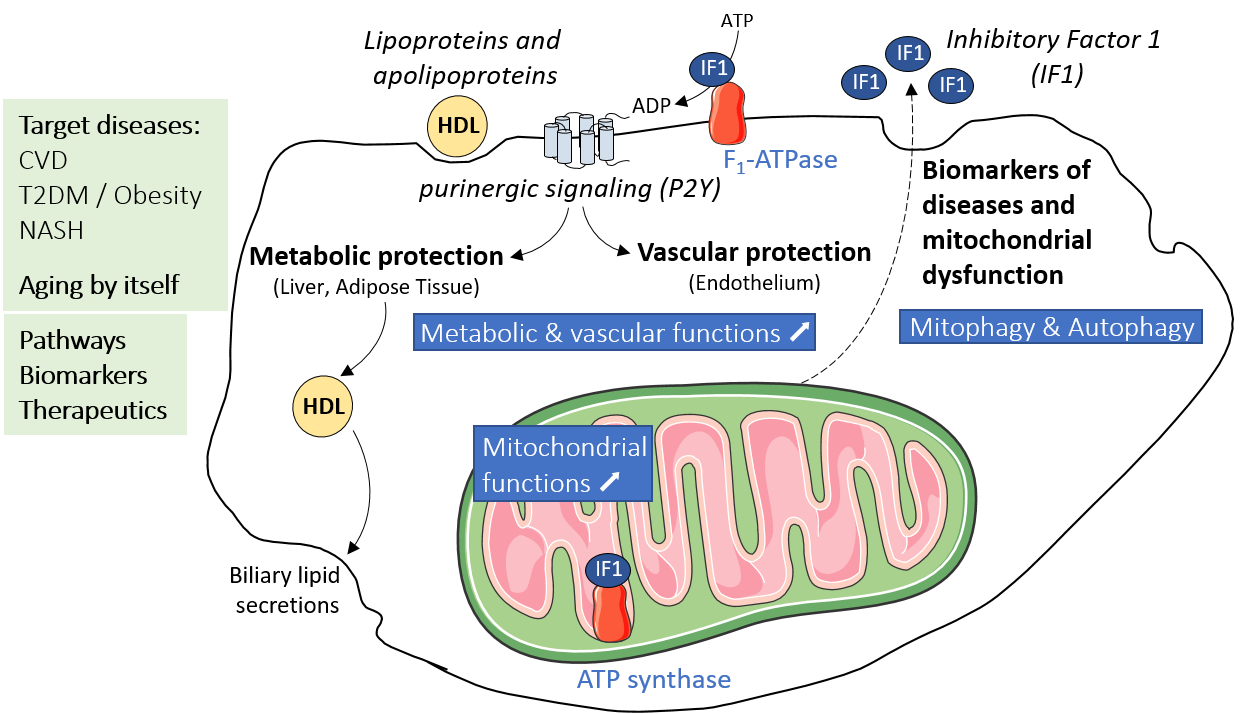
Lipoprotéines et adaptations Mitochondriales dans les maladies vasculaires & métaboliques liées à l’Âge (LiMitAging)
Notre projet consiste à étudier le mécanisme d’action et la fonction de certains acteurs du métabolisme des lipoprotéines et de la fonction mitochondriale dans différents contextes physiopathologiques (vieillissement, dyslipidémie athérogène, dysfonctions hépatiques et vasculaires). Principalement, nous étudions des acteurs moléculaires qui régulent :
1) La phosphorylation oxydative, en particulier l’ATP synthase mitochondriale
2) L’autophagie, en particulier la mitophagie, et l’implication de ce processus dans la communication inter-organites
3) Les voies de signalisation couplées à l’ATP synthase ectopique et aux récepteurs purinergiques P2Y
Nos recherches translationnelles ont conduit au développement de candidats-médicaments et à l’identification de biomarqueurs que nous validons sur des modèles précliniques (cellulaires, organoïdes, animaux) et des cohortes humaines. Ces biomarqueurs et candidats-médicaments sont destinés à être utilisés dans le dépistage, le diagnostic et la résolution des dysfonctionnements métaboliques et mitochondriaux chez les personnes âgées présentant un risque de déclin fonctionnel ou chez des individus à haut risque de maladies cardiométaboliques.
L’Équipe

Laurent MARTINEZ

Cendrine CABOU

Annelise GENOUX

Souad NAJIB

Cécile INGUENEAU

Bertrand PERRET

Céline VERDIER

Mohamad NASSER

Vanessa BOUGUETOCH

Guillaume COMBES

Jeanne TAWBE
Lipoprotéines de Haute Densité (HDL) et ATP synthases dans les dysfonctions métaboliques et cardiovasculaires

Coordinateur : Laurent MARTINEZ
L’ATP synthase est un complexe enzymatique mitochondrial que nous avons également retrouvé exprimé à la membrane plasmique de plusieurs types cellulaires en tant que récepteur à l’apoA-I, la principale protéine HDL.
Dans ce projet, nous explorons les fonctions cellulaires et les voies de signalisation associées aux activités enzymatiques des ATP synthases mitochondriales et de surface cellulaire. Nous étudions également les mécanismes régulant leurs activités. Nous développons des modèles précliniques originaux et des approches pharmacologiques innovantes pour étudier leur rôle dans le processus du vieillissement et dans différentes dysfonctions métaboliques et cardiovasculaires telles que les dyslipidémies, l’athérosclérose, le diabète et la stéatohépatite non alcoolique (Projets Région Occitanie n°19014226 – HEPATOCARE et Région Occitanie / FEDER MP0022856 – Inspire RESPIMITAGING & MITOENERGY).

Lipoprotéines et signalisation purinergique de l’endothélium vasculaire
Coordinateurs : Cendrine CABOU, Laurent MARTINEZ
Les cellules endothéliales, qui tapissent la surface des vaisseaux sanguins pour former l’endothélium, ont un rôle déterminant dans l’homéostasie du système cardiovasculaire. Il est établi qu’une dysfonction ou lésion de l’endothélium vasculaire sont à l’origine des pathologies et complications cardiovasculaires. Les nucléotides extracellulaire tels que l’ADP et l’ATP activent des voies de signalisation impliquées dans la fonction endothéliale (vasomotricité, perméabilité, adhésion cellulaire, etc.).
Dans ce projet, nous étudions la signalisation nucléotidique de l’endothélium vasculaire, en particulier celle médiée par les lipoprotéines de haute densité (HDL) et impliquant l’ATP synthase de surface, dont l’activité hydrolytique génère de l’ADP extracellulaire qui active les récepteurs purinergiques P2Y.
En recherche translationnelle, nous développons une nouvelle famille de molécule et des approches de thérapies cellulaires qui ciblent cette signalisation nucléotidique pour restaurer la fonction endothéliale (Projets Région Occitanie / FEDER MP0018003 – THERANOVASC).

Autophagie dégradative/sécrétoire et communication inter-organites en conditions physiologiques et physiopathologiques

Coordinatrice : Souad NAJIB
L’autophagie est un processus catabolique essentiel pour le maintien de l’homéostasie cellulaire. En plus de son rôle dans la dégradation, l’autophagie est également impliquée dans l’adressage à la membrane plasmique de protéines solubles et transmembranaires.
Dans ce projet, nous explorons ce double rôle de l’autophagie, analysons son interconnexion avec le métabolisme mitochondrial, et étudions les conséquences de son dysfonctionnement sur le développement de maladies métaboliques et cardiovasculaires.
Biomarqueurs associés au métabolisme lipidique et énergétique

Coordinateurs : Annelise Genoux, Bertrand Perret et Laurent Martinez
Nous nous intéressons à la recherche de nouveaux biomarqueurs du risque cardiovasculaire et du syndrome métabolique, lies soit aux fonctions mitochondriales soit au métabolisme des lipoprotéines. L’objectif est de développer des outils de diagnostic qui permettront une stratification précise et précoce des risques. Nos travaux s’appuient sur un consortium comprenant des cliniciens, des épidémiologistes et des entreprises privées et sur l’utilisation de collections biologiques et de cohortes originales locales, nationales et internationales.
publications majeures
P2Y13 receptor deficiency favors adipose tissues lipolysis and worsens insulin resistance and fatty liver disease. Duparc T, Gore E, Combes G, Beuzelin D, Pires Da Silva J, Bouguetoch V, Marquès MA, Velazquez A, Viguerie N, Tavernier G, Arner P, Rydén M, Langin D, Sioufi N, Nasser M, Cabou C, Najib S, Martinez LO. JCI Insight. 2024. Pubmed
Plasma Level of ATPase Inhibitory Factor 1 and Intrinsic Capacity in Community-Dwelling Older Adults: Prospective Data From the MAPT Study. da Silva JA, Martinez LO, Rolland Y, Najib S, Croyal M, Perret B, Jabrane-Ferrat N, El Costa H, Guyonnet S, Vellas B, de Souto Barreto P; MAPT/DSA group. J Gerontol A Biol Sci Med Sci. 2024. Pubmed
Associations between physical activity levels and ATPase inhibitory factor 1 concentrations in older adults. Raffin J, Rolland Y, Genoux A, Combes G, Croyal M, Perret B, Guyonnet S, Vellas B, Martinez LO, de Souto Barreto P; MAPT/DSA Group. J Sport Health Sci. 2023. Pubmed
Intermittent Fasting Resolves Dyslipidemia and Atherogenesis in Apolipoprotein E-Deficient Mice in a Diet-Dependent Manner, Irrespective of Sex. Mérian J, Ghezali L, Trenteseaux C, Duparc T, Beuzelin D, Bouguetoch V, Combes G, Sioufi N, Martinez LO, Najib S. Cells. 2023. Pubmed
Plasma level of ATPase inhibitory factor 1 (IF1) is associated with type 2 diabetes risk in humans: A prospective cohort study. Pires Da Silva J, Wargny M, Raffin J, Croyal M, Duparc T, Combes G, Genoux A, Perret B, Vellas B, Guyonnet S, Thalamas C, Langin D, Moro C, Viguerie N, Rolland Y, Barreto PS, Cariou B, Martinez LO; MAPT/DSA Group. Diabetes Metab. 2023. Pubmed
ILS NOUS SOUTIENNENT

Feder

ANR

fondation de france

region occitanie




Inserm/UPS UMR 1297 - I2MC Institut des Maladies Métaboliques et Cardiovasculaires
1 avenue Jean Poulhès - BP 84225 - 31432 Toulouse Cedex 4
Tél. : 05 61 32 56 00
Horaires
Du lundi au vendredi
8h30 - 12h30 / 13h45 -16h45