Françoise LENFANT / Coralie FONTAINE

Récepteur des œstrogènes ERα : Dysfonctions vasculaires, métaboliques et endocriniennes (ESTER)
L’objectif de l’équipe est de comprendre les mécanismes moléculaires et cellulaires de l’action des récepteurs des œstrogènes ERα et des modulateurs sélectifs des récepteurs des œstrogènes (SERMs) dans ses effets bénéfiques vasculaires et métaboliques. Quatre axes principaux sont développés, en collaboration avec des cliniciens du CHU de Toulouse : 1) prévenir l’apparition de maladies vasculaires liées à l’âge, 2) contribuer au développement de nouvelles molécules œstrogéniques, pour améliorer la sécurité de la contraception orale et du traitement hormonal de la ménopause, 3) comprendre le dialogue entre la signalisation œstrogénique et les rythmes circadiens 4) développer une recherche translationnelle dans le cadre de l’endométriose, pathologie oestrogéno-dépendante.
En savoir plus
Les travaux de Jean-François Arnal et Françoise Lenfant sont sélectionnés pour le Prix Galien 2022 et 2023

JF. Arnal et F. Lenfant ont intégré la Sélection Officielle du prix Galien 2022 et 2023 dans le volet « Travaux de recherche ».
Leur travaux sont mis à l’honneur: le risque artériel coronaire des femmes est diminué par les hormones œstrogènes, mais au prix de certains risques. En comprenant mieux leurs mécanismes d’action, les travaux de Jean-François Arnal et Françoise Lenfant proposent une modulation plus sûre du récepteur des œstrogènes en médecine (contraception, ménopause).
L’Équipe

Françoise LENFANT

Coralie FONTAINE

Jean-François ARNAL

Marine ADLANMERINI

Elodie CHANTELAT

Xavier GAME

Florence TREMOLIERES

Marie VALERA

Mélissa BUSCATO

Adrien GARGAROS

Khrystyna BORIAK

Ariane WEYL

Sylvie Nguyen

Pauline AURIOL

Perrine SINGLA

Faustine Darnaud

Juline MARJOLLET

Anna GOSSET

Emma NOVARINI
OPTIMISATION DE LA MODULATION DU RECEPTEUR DES OESTROGENES
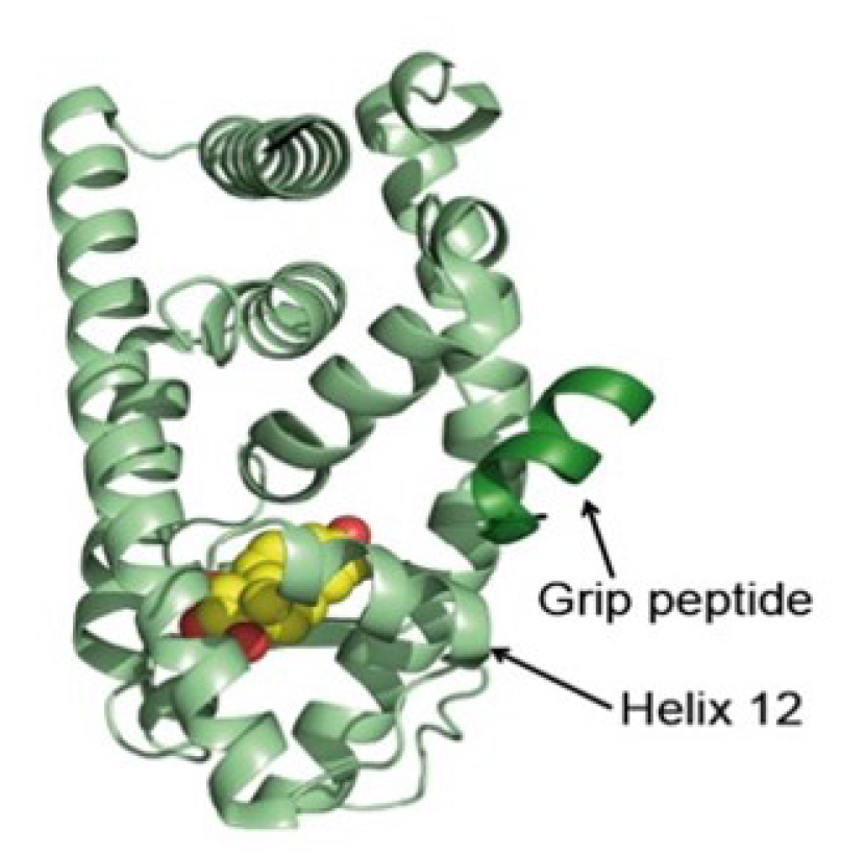
Coordinateurs : Coralie Fontaine, Marine Adlanmerini, Florence Tremolières, Marie-Cécile Valéra, Jean-François Arnal et Françoise Lenfant
En couplant des approches pharmacologiques et l’utilisation de modèles de souris ciblant les différentes sous fonctions de ERα (nucléaires versus membranaires), nous cherchons à optimiser l’activation de ce récepteur pour développer de nouvelles stratégies thérapeutiques visant à optimiser les hormonothérapies utilisées dans diverses pathologies chez la femme (traitement des symptômes de la ménopause, cancer du sein, endométriose…). Nous contribuons à ces développements dans le cadre de partenariats avec une Biotech belge (Mithra) qui développe l’estétrol, un œstrogène fœtal et des Big Pharma (Pfizer).
Pour en savoir plus :
BD In Sciences on page 46 (Estetrol: la fine fleur des oestrogènes): https://www.calameo.com/read/0051544509cf52b7059c6
IMPACT DU VIEILLISSEMENT SUR LA PROTECTION ARTERIELLE PAR LES OESTROGENES
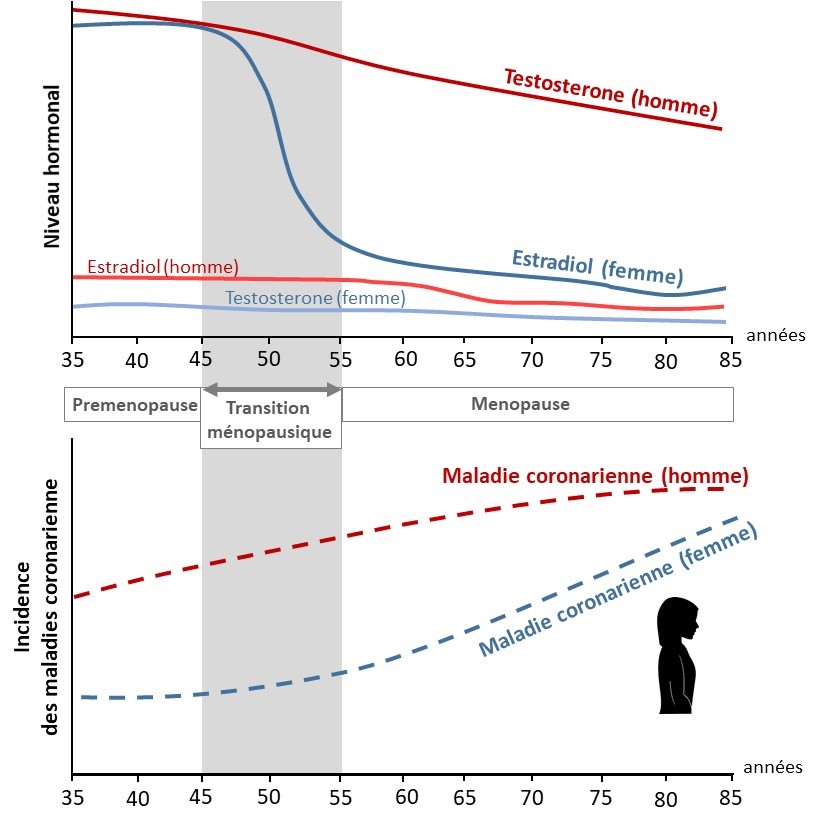
Coordinateurs : Coralie Fontaine, Jean-François Arnal
Les femmes sont protégées vis-à -vis du risque cardiovasculaires par rapport aux hommes jusqu’à la ménopause. Cette protection conférée par les œstrogènes endogènes durant la période d’activité génitale peut être prolongée à condition que les œstrogènes soient administrés précocement après l’apparition de la ménopause. Notre objectif est de comprendre la perte de la protection artérielle par les oestrogènes au cours du vieillissement en étudiant l’impact de l’âge sur la signalisation de leur récepteur ERa dans le vaisseau.
Ce projet est financé par la Fondation de France, l’ANR (ArtER) et l’UE/Région Occitanie (projet FEDER-HUM, conduit en partenariat avec la société Physiostim).


DIALOGUE ENTRE LA SIGNALISATION OESTROGENIQUE ET LA SIGNALISATION CIRCADIENNE
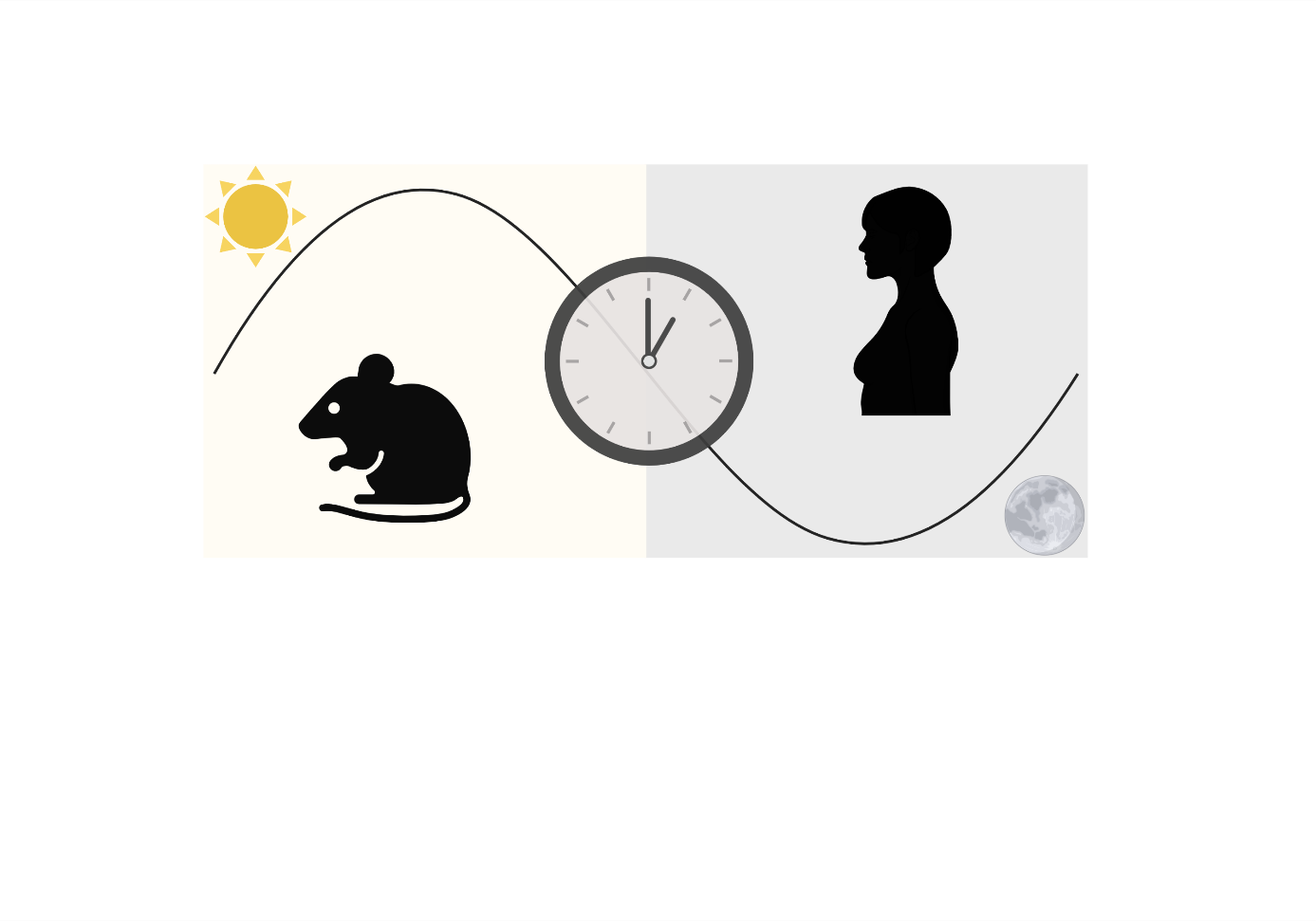
Coordinatrices : Marine Adlanmerini, Coralie Fontaine
En explorant l’hypothèse selon laquelle ERα pourrait agir comme un donneur de temps capable de piloter le métabolisme circadien, notre équipe vise à déterminer les mécanismes moléculaires et les implications physio(patho)logiques du dialogue entre œstrogènes et signalisation circadienne en vue d’optimiser les stratégies thérapeutiques par la chronothérapie (ANR CirER) et prévenir les maladies cardiovasculaires (ANR Helios) chez les femmes ménopausées.
Ce projet est financé par l’ANR (Helios) et l’ANRJC (CircER)
ACTION DES OESTROGENES dans l’ENDOMETRIOSE
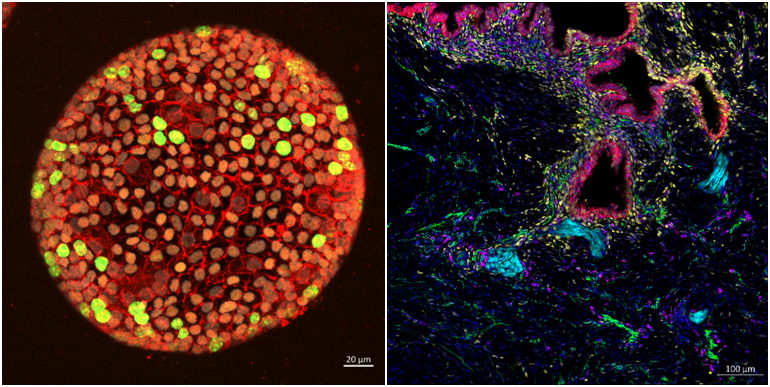
oordinatrices : Elodie Chantalat, Françoise Lenfant
L’endométriose, présente chez 10 % des femmes en âge de procréer, est une maladie gynécologique œstrogèno-dépendante qui se caractérise par la présence de tissu endométrial en dehors de l’utérus, ce qui entraîne des douleurs pelviennes, une infertilité et une altération de la qualité de vie. Notre projet propose une approche multidisciplinaire pour mieux comprendre les mécanismes d’action des œstrogènes dans l’endométriose en travaillant sur tissus humains, fluide péritonéal et en développant une plateforme d’organoïdes dérivés de ces tissus. Le but à terme est de proposer de nouvelles thérapeutiques pour contrôler le processus endométriosique sans induire une privation estrogénique systémique et ses conséquences délétères à long terme.
Projet réalisé en étroite collaboration avec le CHU-Toulouse- Service de chirurgie Gynécologique avec le soutien financier de l’association EndoFrance, Région Occitanie- GRAINE- EndoTREAT, (en partenariat avec Urosphere), ANR-EDISON et du PEPR-Santé des femmes.
SELECTION DE publications
Reprogramming of endothlial gene expression by tamoxifen inhibits angiogenesis and ERa-negative tumor growth. Fébrissy C, Adlanmerini M, Péqueux C, Boudou F, Buscato M, Gargaros A, Gilardi-Bresson S, Boriak K, Laurell H, Fontaine C, Katzenellenbogen BS, Katzenellenbogen JA, Guillermet-Guibert J, Arnal JF, Metivier R, Lenfant F. Theranostics. 2024 Jan 1;14(1):249-264. doi: 10.7150/thno.87306. eCollection 2024. PMID: 38164151 Free PMC article. Pubmed
Special issue on non-genomic actions of nuclear receptors: An evolutionary and physiological perspective. Arnal JF, Fontaine C, Adlanmerini M, Lenfant F. Mol Cell Endocrinol. 2023 Mar 15;564:111884.doi:10.1016/j.mce.2023.111884. Epub 2023 Feb 3. PMID: 36739891. Pubmed
The different natural estrogens promote endothelial healing through distinct cell targets. Davezac M, Zahreddine R, Buscato M, Smirnova NF, Febrissy C, Febrissy C, Laurell H, Gilardi-Bresson S, Adlanmerini M, Liere P, Flouriot G, Guennoun R, Laffargue M, Foidart JM, Lenfant F, Arnal JF, Métivier R, Fontaine C. JCI Insight, 2023. Pubmed
Loss of function of the maternal membrane oestrogen resceptor ERa alters expansion of trophoblast cells and impacts mouse fertility. Rusidzé M, Faure MC, Sicard P, Raymond-Letron I, Giton F, Vessieres E, Prevot V, Henrion D, Arnal JF, Cornil CA, Lenfant F. Development. 2022 Oct 1;149(19):dev200683. doi: 10.1242/dev.200683. Epub 2022 Oct 13. PMID: 36239412. Pubmed
Tamoxifen Accelerates Endothelial Healing by Targeting ERα in Smooth Muscle Cells, Zahreddine R, Davezac M, Smirnova N, Buscato M, Lhuillier E, Lupieri A, Solinhac R, Vinel A, Vessieres E, Henrion D, Renault MA, Gadeau AP, Flouriot G, Lenfant F, Laffargue M, Métivier R, Arnal JF, Fontaine C.,Circ Res, 2020. Pubmed


Inserm/UPS UMR 1297 - I2MC Institut des Maladies Métaboliques et Cardiovasculaires
1 avenue Jean Poulhès - BP 84225 - 31432 Toulouse Cedex 4
Tél. : 05 61 32 56 00
Horaires
Du lundi au vendredi
8h30 - 12h30 / 13h45 -16h45









