Équipe O. KUNDUZOVA / A. PARINI

Remodelage Cardiométabolique : Mécanismes et Microenvironnement (CERAMIC)
Notre programme de recherche se concentre sur l’identification des mécanismes moléculaires qui régissent les processus de remodelage cardiaque et l’utilisation de ces découvertes pour le développement de nouvelles stratégies diagnostiques et thérapeutiques de l’insuffisance cardiaque (IC). La fibrose, l’inflammation et les anomalies métaboliques sont des aspects majeurs du remodelage cardiaque et du dysfonctionnement ventriculaire qui conduisent au développement et à la progression de la dysfonction cardiaque. Nos projets de recherche, axés sur la compréhension de ces dérégulations, bénéficient de l’expertise croisée de cliniciens et de chercheurs universitaires. L’un des objectifs spécifiques est de définir comment le métabolisme régule les fonctions des myocytes et des cellules du stroma et exploiter ces connaissances à des fins thérapeutiques de prévention du remodelage et la dysfonction cardiaques. Nous combinons les technologies » omiques » de pointe avec les principales techniques de la biologie moléculaire, de la biologie cellulaire, de la biochimie, de la (patho)physiologie et de la pharmacologie pour identifier et de caractériser de nouveaux acteurs de la biologie cardiovasculaire. Les programmes de recherche translationnelle de notre équipe favorisent l’intégration multidisciplinaire de la recherche fondamentale et de la recherche orientée vers le patient, en passant du laboratoire au chevet du patient.
L’Équipe

Oxana KUNDUZOVA

Angelo PARINI

Nathalie PIZZINAT

Véréna POINSOT

Jérôme RONCALLI

Charlotte ROUZAUD LABORDE

Kévin CHANDRESHWAR

Virginie JACQUES

Dimitri MARSAL

Solomiia KRAMAR

Lesia SAVCHENKO

Ryeonshi KANG

Audrey SWIADER
Reprogrammation métabolique des cellules stromales au cours du remodelage cardiaque et impact sur le microenvironnement inflammatoire
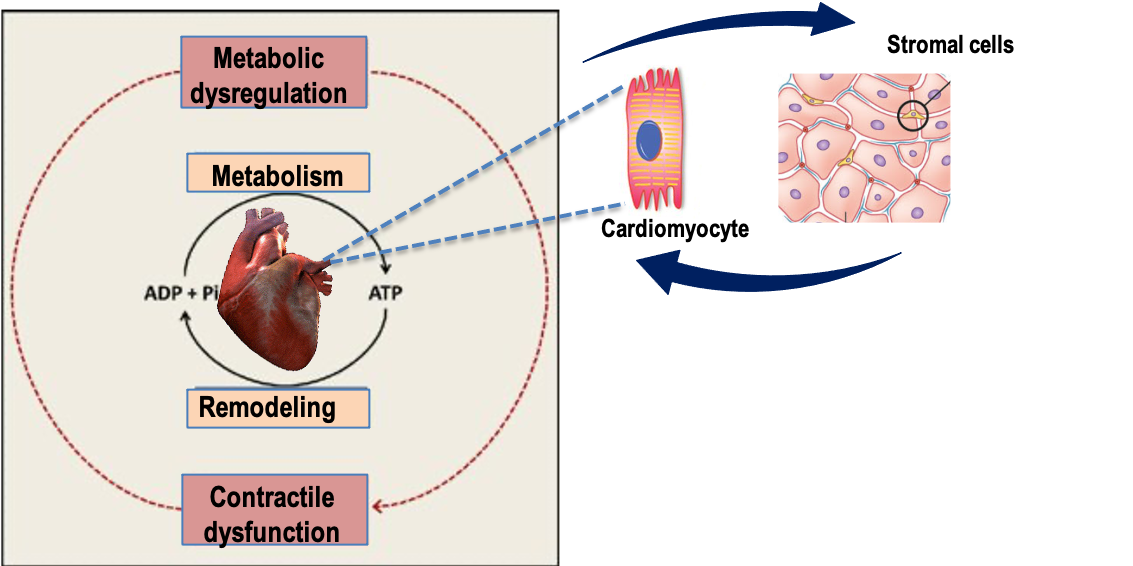
Coordinateurs : O. Kunduzova, F. Savagner, V. Poinsot, D. Cussac, A. Parini
Grâce à notre programme de recherche, nous visons à caractériser la reprogrammation métabolique de la transition fibroblaste-myofibroblaste dans le remodelage fibrotique du myocarde. Nous explorons également la relation entre le profil métabolique des cellules stromales mésenchymateuses cardiaques, leurs activités sécrétoires, et les conséquences sur les cellules immuno-inflammatoires dans les conditions prédisposant à l’insuffisance cardiaque (surcharge de pression, obésité, vieillissement) .
Métabolisme des phosphoinositides et signalisation dans le remodelage cardiométabolique

Coordinateurs : F. Boal, H. Tronchère, O. Kunduzova
Nos recherches portent sur le rôle du phosphoinositide rare phosphatidylinositol 5-phosphate (PI5P) dans le remodelage cardiaque. Plus précisément, nous cherchons à décrypter l’implication de ses voies de biosynthèse dans le remodelage fibrotique et cardiométabolique. En particulier, nous étudions le rôle de la lipide kinase PIKfyve et de la phosphatase myotubularine MTM1 dans les altérations métaboliques des cardiomyocytes et l’activation des fibroblastes cardiaques au cours de la progression de l’insuffisance cardiaque.
Approches translationnelles vers la recherche clinique
Coordinateur : J. Roncalli, C. Laborde, A. Parini
La partie recherche translationnelle de notre projet concerne deux axes majeurs : 1) la conception de nouvelles stratégies ciblant les défis de la médecine régénérative cardiaque. Ceci passe par la compréhension des paramètres influençant le passage de la compensation à la décompensation de la fonction d’éjection cardiaque accompagné au remodelage fibrotique du tissu cardiaque. et 2) l’identification de nouvelles cibles thérapeutiques et biomarqueurs de la dysfonction cardiaque associée à l’obésité et au vieillissement. Notre groupe a une grande expérience sur les approches de thérapie cellulaire cardiaque utilisant les cellules souches mésenchymateuses de la moelle osseuse (BM-MSCs). De plus, nous avons développé une stratégie alternative basée sur la conception de BM-MSCs/biomatrices grâce à des techniques de bio-ingénierie pour la délivrance locale de facteurs paracrines bénéfiques sans effets secondaires majeurs liés à l’injection intramyocardique.
publications MAJEURES
Apilimod alters TGFβ signaling pathway and prevents cardiac fibrotic remodeling. Cinato M, Guitou L, Saidi A, Timotin A, Sperazza E, Duparc T, Zolov SN, Giridharan SSP, Weisman LS, Martinez LO, Roncalli J, Kunduzova O, Tronchere H, Boal F. Theranostic. 2021. Pubmed
Galanin promotes autophagy and alleviates apoptosis in the hypertrophied heart through FoxO1 pathway. Martinelli I, Timotin A, Moreno-Corchado P, Marsal D, Kramar S, Loy H, Joffre C, Boal F, Tronchere H, Kunduzova O. Redox Biol. 2021. Pubmed
Local production of tenascin-C acts as a trigger for monocyte/macrophage recruitment that provokes cardiac dysfunction. Abbadi D , Laroumanie F, Bizou M, Pozzo J, Daviaud D, Delage D, Calise D, Gaits-Iacovoni F, Dutaur M, Tortosa F, Renaud-Gabardos E , Douin-Echinard V, Prats A.C, Roncalli J, Parini A, and Pizzinat N Cardiovasc Res. 2018. Pubmed
Surfing the clinical trials of mesenchymal stem cell therapy in ischemic cardiomyopathy.
Aging induces cardiac mesenchymal stromal cell senescence and promotes endothelial cell fate of the CD90 + subset.
ILS NOUS SOUTIENNENT






Inserm/UPS UMR 1297 - I2MC Institut des Maladies Métaboliques et Cardiovasculaires
1 avenue Jean Poulhès - BP 84225 - 31432 Toulouse Cedex 4
Tél. : 05 61 32 56 00
Horaires
Du lundi au vendredi
8h30 - 12h30 / 13h45 -16h45