équipe A. Bouloumié
DINAMIX: Tissus adipeux et flexibilité vasculo-métabolique
Notre recherche vise à élucider les mécanismes moléculaires et cellulaires impliqués dans l’adaptation métabolique dans des contextes physiologiques et au cours du vieillissement qu’il soit physiologique ou accéléré par l’obésité. Nous nous attachons 1) à caractériser l’hétérogénéité cellulaire et fonctionnelle des différents dépôts adipeux blancs et bruns, et 2) à déterminer leur contribution à la flexibilité vasculo-métabolique.
Parallèlement, nous étudions l’influence de la distribution corporelle des tissus adipeux sur les altérations de la régénération et de la fonction de barrière de l’épithélium intestinal présentes dans les maladies inflammatoires chroniques de l’intestin et dans les contextes d’obésité.
L’Équipe

Anne BOULOUMIE-DIEHL

Anaïs BRIOT

Xavier COLLET

Audrey FERRAND

Florence TATIN

Pauline DECAUNES BESSEDE

Léopold Devineaux

Muriel QUARANTA-NICAISE

Juline MARJOLLET

Morgane LEVEQUE

Alexis ARCAS

Anna Gosset

Duvan ROJAS-GARCIA

Théo CALDERON

Rémi CENTRES
Fonction métabolique de l’endothélium microvasculaire: hétérogénéité, detection et gestion des nutriments
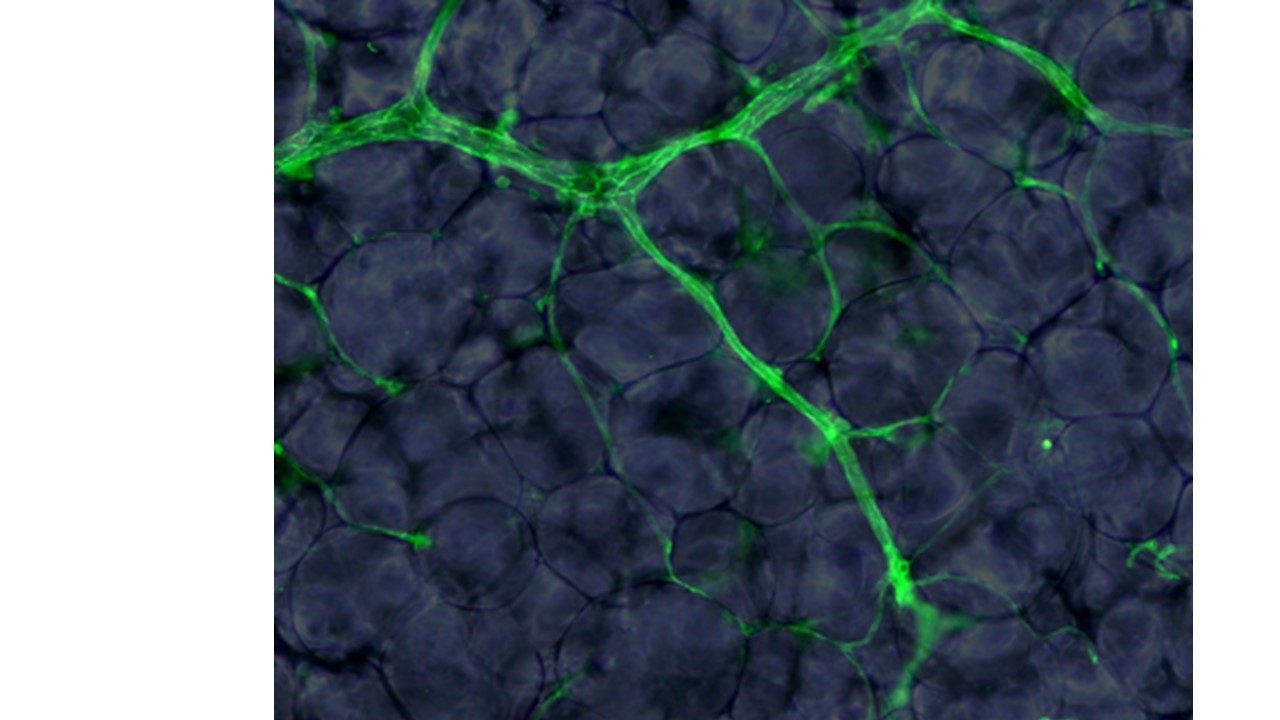
Coordinatrices : Anaïs Briot, Anne Bouloumié
Nos travaux sur les cellules endothéliales microvasculaires natives et primaires des dépôts adipeux sous-cutanés et viscéraux humains et murins visent à 1) identifier les mécanismes cellulaires et moléculaires mis en jeu dans la détection et le transport des nutriments, 2) cartographier les sous-populations endothéliales contribuant à la gestion des flux métaboliques et 3) évaluer l’impact de l’obésité et du vieillissement sur la fonction métabolique de la vasculature des dépôts adipeux humains et murins.
Des cellules progénitrices vers les adipocytes matures : Hétérogénéité, différenciation et fonction
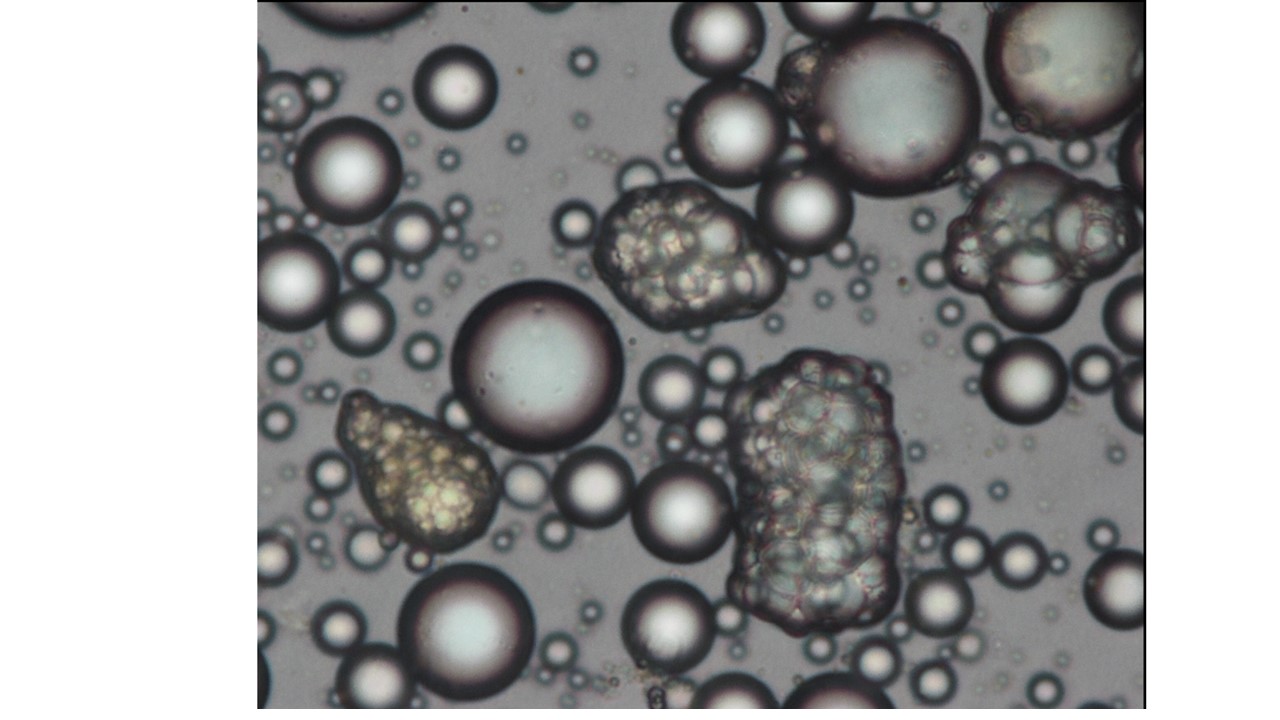
Coordinateurs : Anne Bouloumié
Nos objectifs sont de définir les mécanismes moléculaires intrinsèques et extrinsèques gouvernant l’hétérogénéité des adipocytes et des cellules progénitrices en terme de leur devenir adipogenique (blanc, beige et brun) et myofibrogenique et de leur niche intra-lobule et inter-dépôts dans des contextes physiologiques et pathologiques de vieillissement naturels ou accéléré par l’obésité.
Dynamique et adaptation deS dépôts adipeux:
Flexibilité Vasculométabolique et jeûne
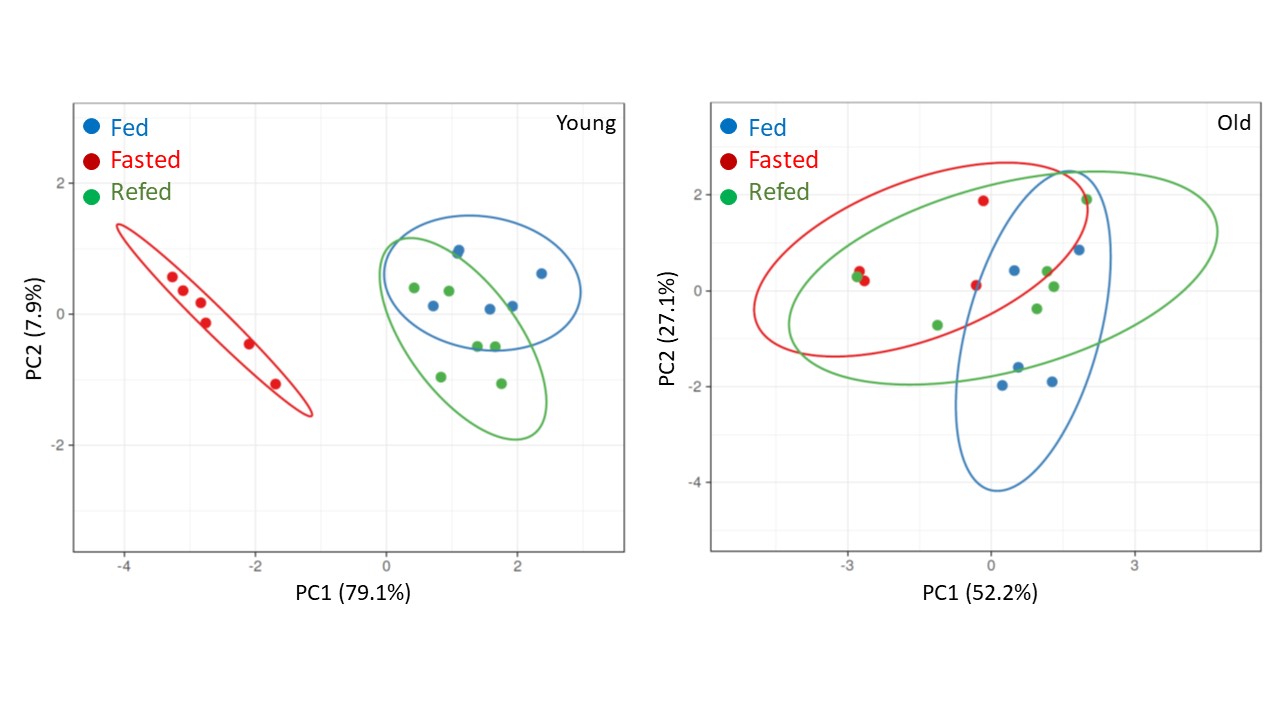
Coordinatrice : Anaïs Briot
A l’aide de différents protocoles de jeûne, nos objectifs sont 1) d’identifier des combinaisons dynamiques de marqueurs (métabolomique, transcriptomique et métagénomique) de l’inflexibilité métabolique, 2) d’évaluer les conséquences bénéfiques et délétères sur le phénotype et la fonctionnalité des cellules des dépôts adipeux et 3) d’identifier des mécanismes cellulaires et moléculaires reproduisant de manière sélective les effets bénéfiques du jeûne intermittent en fonction du sexe, de l’âge et de la santé métabolique.
Adaptabilité de l’endothélium lymphatique dans les maladies métaboliques
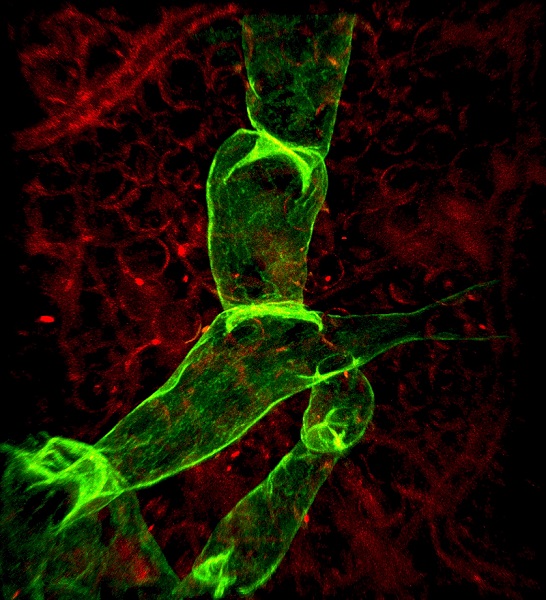
Coordinatrices : Florence Tatin, Anais briot, Anne Bouloumie
Florence Tatin s’intéresse à la compréhension de l’adaptabilité et de l’hétérogénéité de l’endothélium lymphatique dans les maladies métaboliques. Nous nous intéressons à déterminer l’organisation spatiale du réseau lymphatique dans le microenvironnement du tissu adipeux avec de nouvelles approches d’imagerie 3D par microscopie à feuille de lumière (IMACTIV-3D). De plus, l’obésité est reconnue comme un important facteur de risque menant à un dysfonctionnement du système lymphatique. Notre objectif est de mieux comprendre comment le tissu adipeux peut influencer et interagir avec les cellules endothéliales lymphatiques, et inversement comment un dysfonctionnement des vaisseaux lymphatiques peut altérer les réponses cellulaires du tissu adipeux. Dans ce but, nous développons des diverses approches allant du single-cells RNAseq des cellules endothéliales, de tri-cellulaire vers des analyses de biologie cellulaire et de biochimie. Projet région Occitanie/ FEDER APELYM-3D.
Dialogue dépôts adipeux-épithélium intestinal et altération tissulaire dans l’obésité, les maladies inflammatoires chroniques de l’intestin et le cancer
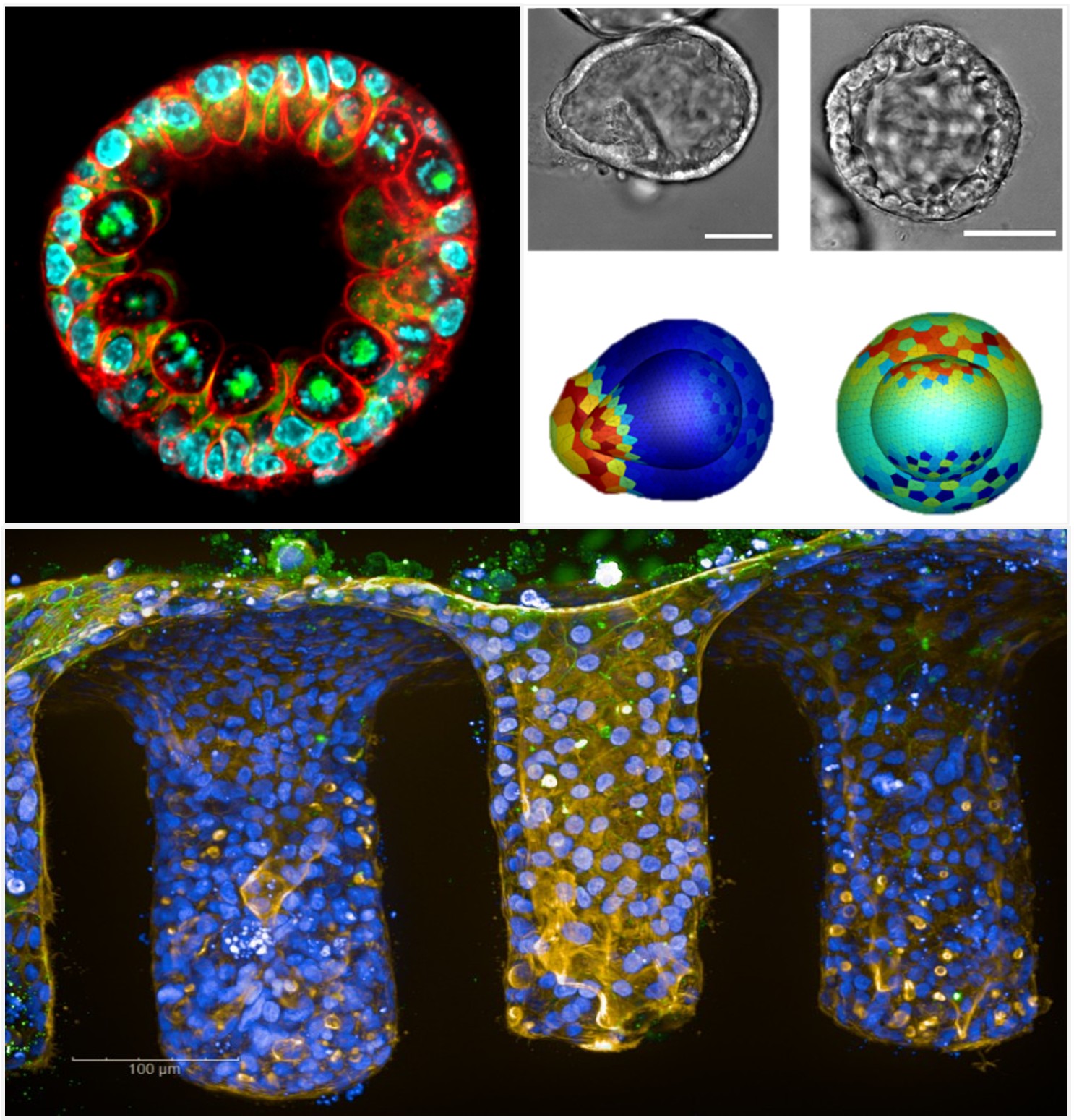
Coordinatrices : Audrey Ferrand, Anne Bouloumié
Nous formulons l’hypothèse que, dans un contexte d’obésité, les modifications architecturales, métaboliques et inflammatoires des dépôts adipeux mésentérique et omental, en tant qu’éléments du macroenvironnement de la crypte intestinale, contribuent aux dysfonctionnements des capacités de renouvellement des cellules souches intestinales et compromettent la fonction de barrière de l’épithélium. Par ailleurs, dans les maladies inflammatoires chroniques de l’intestin (MICI) et le cancer colorectal, les altérations de l’épithélium et du stroma pourraient en retour influencer les propriétés métaboliques et immunitaires de ces dépôts adipeux.
En combinant des analyses fonctionnelles, pharmacologiques et architecturales, avec des approches multidisciplinaires intégrant la biomécanique, la bio-ingénierie, l’imagerie 4D, ainsi que des méthodes avancées de machine learning et de deep learning, nous visons à caractériser les interactions entre l’épithélium intestinal et son micro- et macro-environnement, en particulier la niche stromale et les dépôts adipeux, et ainsi élucider leur contribution aux mécanismes physiopathologiques impliqués dans l’obésité, les MICI et le cancer colorectal.
Ces projets sont notamment développés dans le cadre de l’axe NAMs de l’I2MC et du PEPR MED-OOC (https://www.pepr-medooc.fr/).

publications RECENTES
Non-destructive assessment of multi-material microtissue mechanics reveals the critical role of rigidity gradients in tumour growth and pressure. Ala A, Douillet C, Ferrand A, Velay V, Segonds S, Recher G, Bugarin F. Acta Biomateriala. 2025. In press.
3D imaging and single-cell analysis reveal cellular heterogeneity of lymphatic valve endothelial cell types. E, Morin R, Iacovoni JS, Draia-Nicolau T, Gomes A, M, Bernes-Lasserre P, Lagarde JM, AC, Garmy-Susini B, Bouloumié A, Anaïs Briot A, Tatin F. iScience. 2025. Open access
Unveiling how mitotic spindle orientation in 3D human colon organoids affects matrix displacements through a 4D study using DVC. Magne L, Pottier T, Michel D, Laussu J, Bonnet D, Alric L, Segonds S, Recher G, Bugarin F, Ferrand A.Sci Rep. 2025. PMID: 40595987. Pubmed.
Lack of fibro-inflammatory response in human mammary adipose tissue in obesity. Fallone F, Rebeaud M, Bouche C, Fontaine J, Arellano C, Ducoux-Petit M, Orgerit L, Deudon R, Nicolle R, Franchet C, Estève D, Mouton-Barbosa E, Dauvillier S, Moutahir M, Burlet-Schiltz O, Bouloumié A, Vaysse C, Muller C. Int J Obes (Lond). 2025. PMID: 39738492. Pubmed.
Deciphering the interplay between biology and physics with a finite element method-implemented vertex organoid model : A tool for the mechanical analysis of cell behavior on a spherical organoid shell. Laussu J, Michel D, Magne L, Segonds S, Marguet S, Hamel D, Quaranta-Nicaise M, Barreau F, Mas E, Velay V, Bugarin F, Ferrand A. PLoS Comput Biol. 2025. PMID: 39792958. Pubmed.
Endothelial DLL4 is an Adipose Depot-Specific fasting sensor regulating fatty acid fluxes. Aupetit A, Decaunes P, Belles C, Riant E, Galitzky J, Chapouly C, Laisné M, Flores-Flores R, Chaput B, Vié K, Arnal JF, Bouloumié A, Briot A. Arterioscler Thromb Vasc Biol. 2023 PMID: 36924232. Pubmed
Notch activation shifts the fate decision of senescent progenitors toward myofibrogenesis in human adipose tissue. Boulet N, Briot A, Jargaud V, Estève D, Rémaury A, Belles C, Viana P, Fontaine J, Murphy L, Déon C, Guillemot M, Pech C, Veeranagouda Y, Didier M, Decaunes P, Mouisel E, Carpéné C, Iacovoni JS, Zakaroff-Girard A, Grolleau JL, Galitzky J, Ledoux S, Guillemot JC, Bouloumié A. Aging Cell. 2023 Jan 8:e13776. Pubmed
Periprostatic Adipose Tissue Displays a Chronic Hypoxic State that Limits Its Expandability. Am J Pathol. 2022 Jun;192(6):926-942. Pubmed


Inserm/UPS UMR 1297 - I2MC Institut des Maladies Métaboliques et Cardiovasculaires
1 avenue Jean Poulhès - BP 84225 - 31432 Toulouse Cedex 4
Tél. : 05 61 32 56 00
Horaires
Du lundi au vendredi
8h30 - 12h30 / 13h45 -16h45












