EQUIPE F. Lezoualc’h
SIGNALING AND PATHOPHYSIOLOGY OF HEART FAILURE AND AGING
Notre équipe associe des chercheurs et des cliniciens dont l’intérêt commun est de comprendre les mécanismes moléculaires et cellulaires impliqués dans l’insuffisance cardiaque (IC). L’objectif final est d’identifier de nouvelles cibles thérapeutiques pour prévenir ou freiner la progression de l’IC.
L’éQUIPE

Frank LEZOUALC’H

Caroline CONTE

Bertrand MARCHEIX

Clément DELMAS

Olivier LAIREZ

Jean PORTERIE

Yohan SANTIN

Karina FORMOSO

Maximin DETRAIT

Jessica RESTA

Dorian BERGONNIER

Ezechiel AGBEGBO

Françoise PUJOL
Recherche de nouvelles cibles thérapeutiques dans l’insuffisance cardiaque à fraction d’éjection préservée
Karina Formoso, Maximin Détrait, Dorian Bergonnier, Olivier Lairez, Bertrand Marcheix, Clément Delmas, Jean Porterie , Jessica Resta, Yannis Sainte-Marie, Yohan Santin, Frank Lezoualc’h
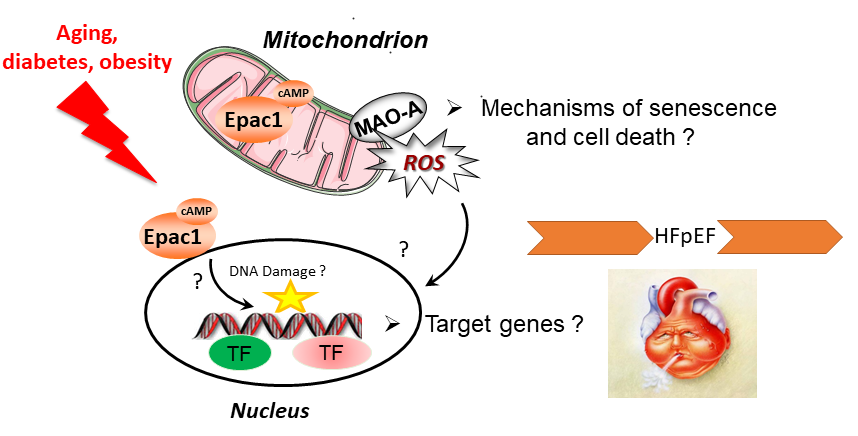
L’insuffisance cardiaque à fraction d’éjection préservée (ICFP) est la forme la plus courante d’IC car elle est favorisée par le vieillissement, le diabète et l’obésité. Elle est caractérisée par une altération du remplissage et de la relaxation cardiaque, pour laquelle il n’existe aucune thérapie efficace. La compréhension des mécanismes régulant le remodelage cardiaque (ex : hypertrophie, sénescence, mort cellulaire) dans le contexte du diabète/de l’obésité et du vieillissement pourrait ouvrir la voie à de nouveaux traitements pour l’ICFP. Notre équipe a caractérisé des événements moléculaires qui sont fortement impliqués dans le remodelage cardiaque. Ces « signalosomes » sont localisés dans différents compartiments subcellulaires et impliquent la protéine sensible à l’AMPc, Epac1 ou la monoamine oxydase-A (MAO-A). Pionniers dans la découverte de ces protéines dans le coeur, nous avons acquis une forte expertise de ces cibles et développé une panoplie d’outils pharmacologiques et de modèles animaux qui pourraient permettre de développer de nouvelles stratégies thérapeutiques.
Voies de signalisation impliquées dans l’insuffisance cardiaque et le vieillissement
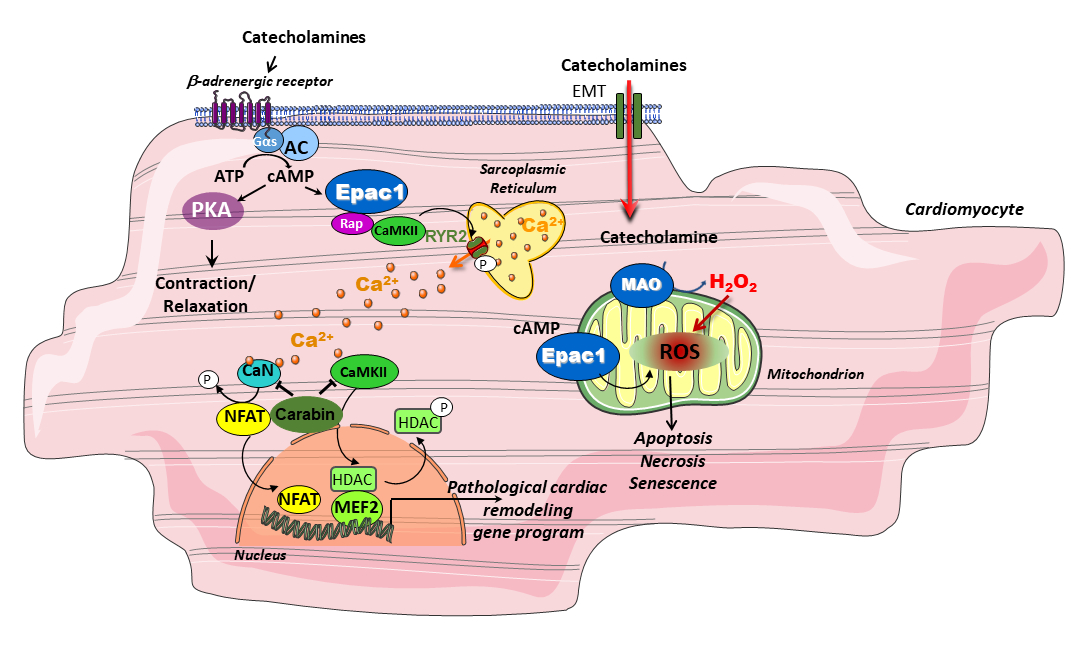
Nous avons identifié de nouveaux acteurs moléculaires impliqués dans l’insuffisance cardiaque (IC) et le vieillissement. Notre objectif est maintenant de disséquer le signalosome de ces protéines (Epac/Carabin/MAO-A) afin de mieux comprendre comment elles influencent le devenir cellulaire. Nous analysons leurs événements moléculaires dans différents compartiments du cardiomyocyte et déterminons leurs gènes cibles. Notre approche est pluridisciplinaire : nous recherchons des modulateurs pharmacologiques de ces cibles thérapeutiques et développons des modèles d’IC.
THERAPIES CARDIAQUES CIBLANT EPAC 1
Karina Formoso, Maximin Détrait, Olivier Lairez, Clément Delmas , Dorian Bergonnier, Frank Le-zoualc’h
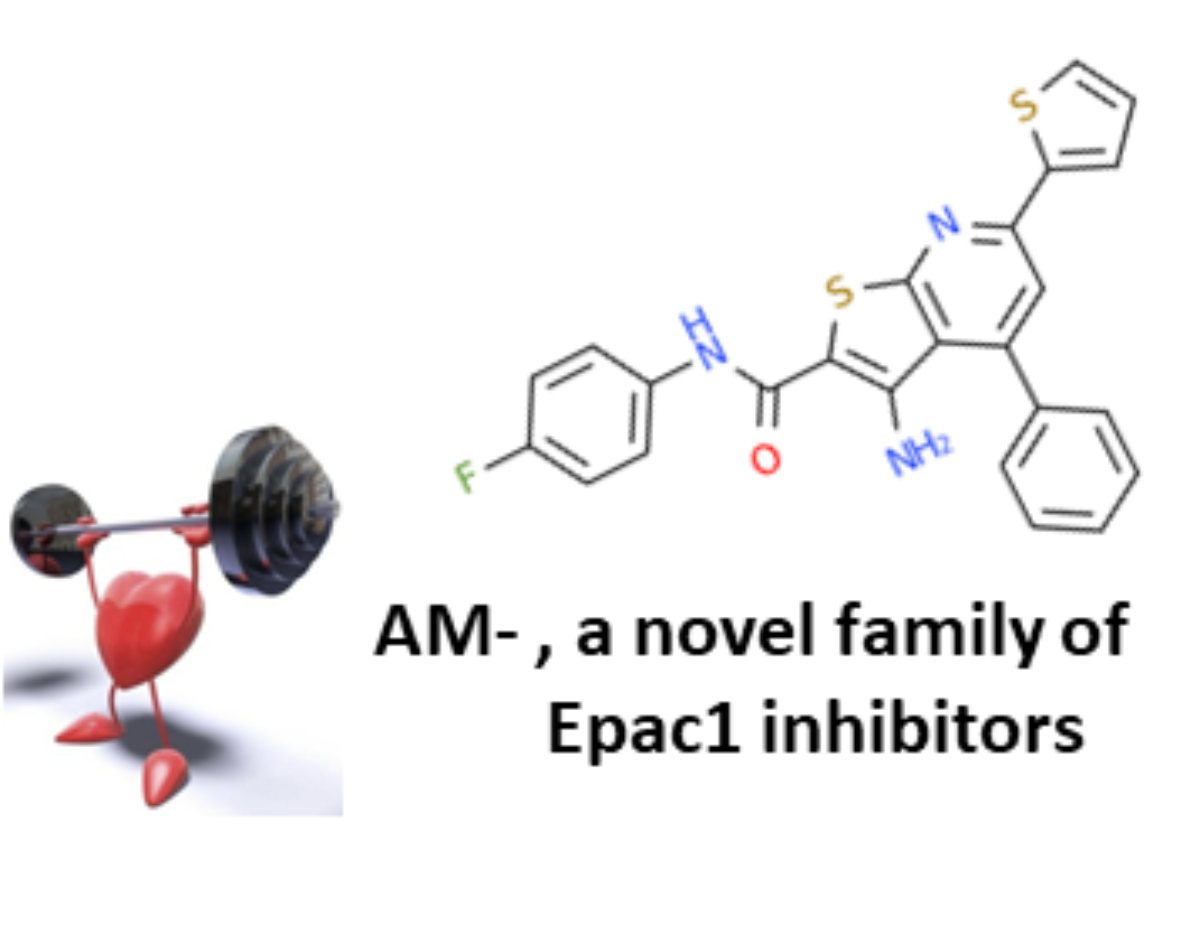
Nous avons démontré que l’inhibition génétique de Epac1 est cardioprotectrice dans diverses conditions de stress cardiaque telles que l’ischémie myocardique. L’inhibition pharmacologique de Epac1 pourrait donc être bénéfique pour le traitement des maladies cardiaques. Pour tester cette hypothèse, nous avons établi divers tests fonctionnels et isolé, par des tests de criblage moléculaire à haut débit et virtuels, les 2 premières familles d’inhibiteurs pharmacologiques et sélectifs de Epac1. La première génération d’inhibiteur nommée CE3F4 est une tétrahydroquino-léine et se comporte comme un inhibiteur non compétitif. La deuxième génération d’inhibiteur est une sous-famille de la thiéno[2,3-b]pyridine et est nommée AM-. Cette nouvelle famille de molé-cule bloque l’activité de Epac1 à la fois in vitro et in vivo. Nous étudions actuellement les effets de l’AM- et du CE3F4 dans divers modèles expérimentaux de maladies cardiaques afin de tester l’efficacité thérapeutique de l’inhibition de l’activité de cette protéine.
DEVELOPPEMENT DE NANOPARTICULES POUR CONTRER L’INSUFFISANCE CARDIAQUE
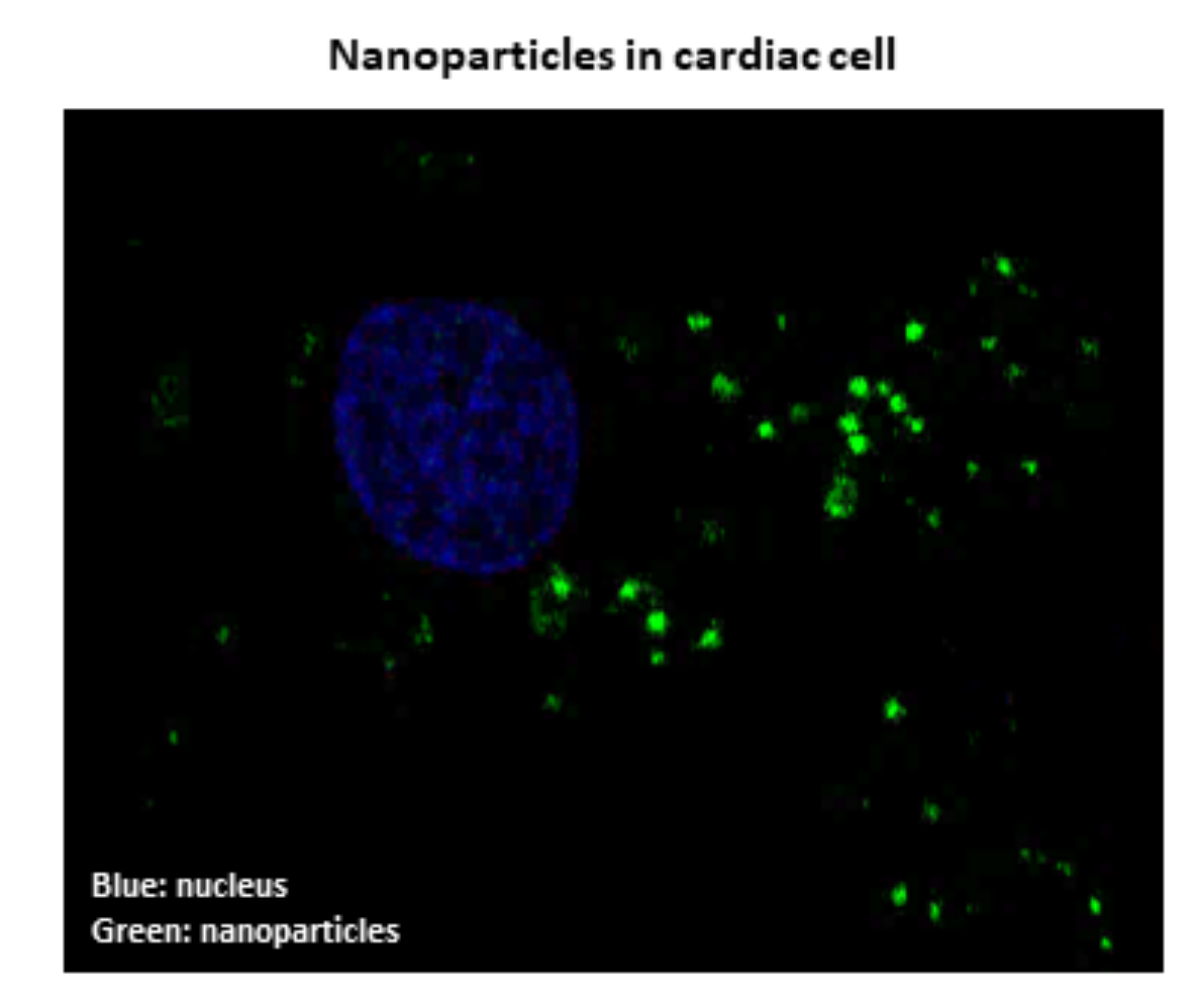
Yohan Santin, Maximin Détrait, Jessica Resta, Frank lezoualc’h
De nombreuses études ont montré que la dysfonction de l’autophagie, un processus dynamique permettant d’éliminer les composants intracellulaires endommagés, jouait un rôle important dans la mise en place de l’Insuffisance Cardiaque. Ainsi, une amélioration de l’autophagie pourrait con-trer la mort des cardiomyocytes et ainsi contribuer à lutter contre la dysfonction contractile du coeur. Nous développons des nanoparticules visant à rétablir l’autophagie en agissant spécifi-quement sur les lysosomes. Les lysosomes sont des structures cellulaires qui dégradent le ma-tériel endommagé permettant son élimination ou son recyclage. Nous avons montré une bonne efficacité de ces nanoparticules pour protéger les cellules cardiaques de la mort induite par diffé-rents agents de stress. Les nanoparticules sont actuellement évaluées pour leur capacité à limi-ter le développement de l’insuffisance cardiaque.
CARACTERISATION FONCTIONNELLE DE NOUVELLES CIBLES EPIGENETIQUES
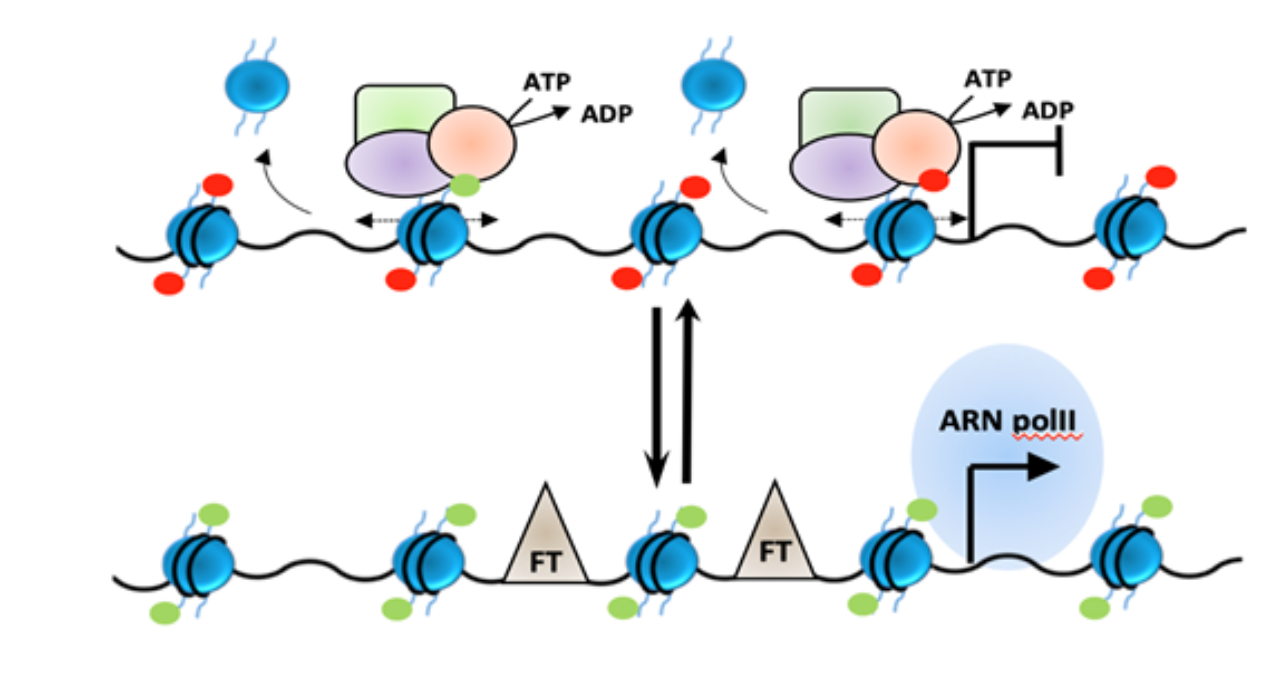
Loubna Kehal, Dorian Bergonnier, Yannis Sainte-Marie, Olivier Lairez, Frank Lezoualc’h, Caroline Conte
Les marqueurs épigénétiques sont récemment apparus comme des éléments clés dans le déve-loppement des maladies cardiovasculaires, suggérant que les modificateurs de la chromatine peuvent représenter des cibles prometteuses pour le développement de nouvelles thérapies. L’hypertrophie cardiaque, étape précoce dans l’évolution clinique de l’insuffisance cardiaque, est mise en place en réponse à l’activation de diverses voies de signalisation qui activent un pro-gramme génique caractérisé par la ré-expression de certains gènes fœtaux et la répression de gènes spécifiques des cardiomyocytes matures. Bien que les données montrent une signature épigénétique spécifique dans les cardiomyocytes hypertrophiques, les liens entre les voies de signalisation bien caractérisées et les modifications épigénétiques sont encore mal compris. Nous nous intéressons à deux enzymes épigénétiques modifiant les profils de méthylation des histones dans les cardiomyocytes en réponse au stress cardiaque. Nous cherchons à com-prendre d’une part le rôle de ces enzymes dans l’activation du programme génique hypertro-phique et d’autre part, les mécanismes régulant leur activité et leur recrutement en réponse au stress cardiaque.
Selected publications
Mitochondrial 4-HNE derived from MAO-A promotes mitoCa2+ overload in chronic post-ischemic cardiac remodelling.
Santin Y, Fazal L, Sainte-Marie Y, Sicard P, Maggiorani D, Tortosa F, Yücel Yücel Y, Teyssedre L, Rouquette J, Marcellin M, Vindis C, Shih JC, Lairez O, Burlet-Schiltz O, Parini A, Lezoualc’h F and Mialet-Perez J. . Cell Death and Differentiation (2020).. Pubmed
Rational re-design of Monoamine Oxidase A into a dehydrogenase to probe ROS in cardiac ageing.
Giacinto Iacovino L, Manzella N, Resta J, Vanoni MA, Rotilio Laura, Pisani L, Edmondson DE, Pa-rini A, Mattevi A, Mialet-Perez J, Binda C.ACS Chem Biol (2020) . Pubmed
Identification of a pharmacological inhibitor of Epac1 that protects the heart against acute and chronic models of cardiac stress. .
Laudette M, Coluccia A, Sainte-Marie Y, Solari A, Fazal L, Sicard P, Silvestri R, Mialet-Perez J, Pons S, Ghaleh B, Blondeau JP, Lezoualc’h F. Cardiovasc Res. (2019). Pubmed
Monoamine oxidase-A is a novel driver of stress-induced premature senescence through inhibi-tion of parkin-mediated mitophagy.
Manzella N, Santin Y, Maggiorani D, Martini H, Douin-Echinard V, Passos JF, Lezoualc’h F, Binda C, Parini A and Mialet-Perez J.. Aging Cell (2018). . Pubmed
The multifunctional mitochondrial Epac1 controls myocardial cell death
Fazal L, Laudette M, Paula-Gomes S, Pons S, Conte C, Tortosa F, Sicard P, Sainte-Marie Y, Bis-serier M, Lairez O, Lucas A, Roy J, Ghaleh B, Fauconnier J, Mialet-Perez J, Lezoualc’h F. Circ Res (2017) . Pubmed
ILS NOUS SOUTIENNENT










Inserm/UPS UMR 1297 - I2MC Institut des Maladies Métaboliques et Cardiovasculaires
1 avenue Jean Poulhès - BP 84225 - 31432 Toulouse Cedex 4
Tél. : 05 61 32 56 00
Horaires
Du lundi au vendredi
8h30 - 12h30 / 13h45 -16h45
