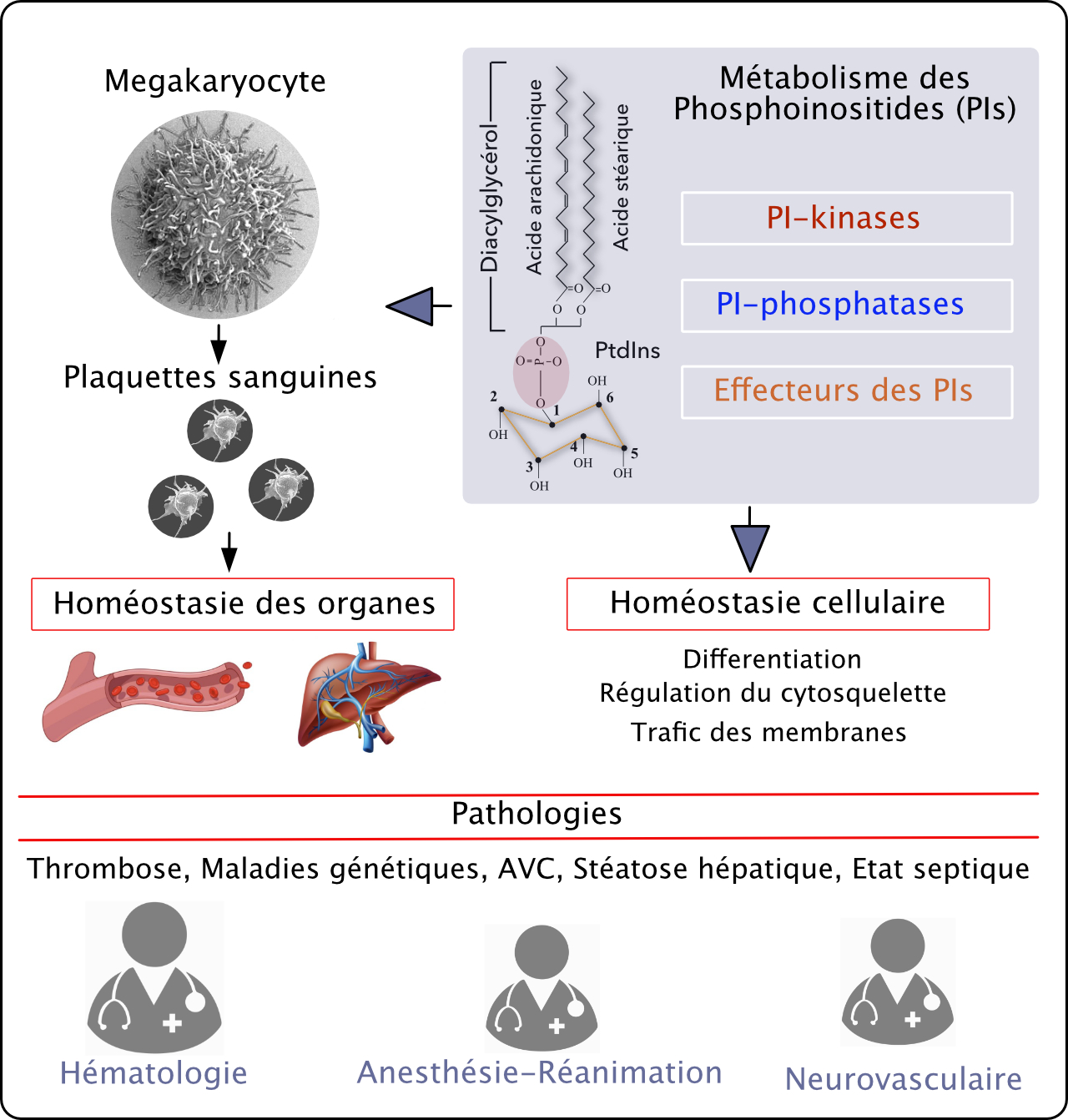
Lipidomique et signalisation dans la production et les fonctions plaquettaires, la thrombose et l’homéostasie cellulaire (LIPSIPLAT)
Nous étudions le métabolisme des phosphoinositides (PIs) dans un contexte fondamental et physiopathologique. Nous employons des approches intégratives et translationnelles (connections étroites avec les services cliniques) pour décortiquer le rôle des PIs dans le système vasculaire (plaquettes et endothélium) et dans le muscle squelettique.
L’Équipe

Bernard PAYRASTRE

Sonia SEVERIN

Marie-Pierre GRATACAP

Julien VIAUD

Christophe COGNARD

Thibault LHERMUSIER

Agnès RIBES

Sophie VOISIN

Fanny VARDON-BOUNES

Gaëtan CHICANNE

Cédric GARCIA

Jean-Marie Xuereb

Anne MAZARS

Laura BOUVET

Oportune KPOTOR

Juline ARDANUY

Christophe FERREIRA

Mathilde MIQUEL

Nadège PREUILH

Claire CONGNET
Métabolisme des phosphoinositides dans l’homéostasie cellulaire et implications en physiopathologie

Coordinateurs : Julien VIAUD, Bernard PAYRASTRE
Par des approches de biologie cellulaire et de biochimie, nous étudions le rôle des phosphoinositides à l’aide de modèles d’étude présentant des altérations de leur métabolisme dans la dynamique des membranes et du cytosquelette dans les mégacaryocytes, plaquettes et cellules musculaires.
Biologie et fonction intégrative des plaquettes dans la physiopathologie des organes

Coordinateurs : Sonia SEVERIN, Marie-Pierre GRATACAP, Bernard PAYRASTRE
Nous étudions la fonction plaquettaire dans l’hémostase et la thrombose mais aussi dans le dialogue avec le système immunitaire et l’endothélium des organes. Nous utilisons des approches fondamentales et translationnelles pour décortiquer le rôle des plaquettes dans différents contextes physiopathologiques tels que les syndromes métaboliques et les maladies cardiovasculaires et la thromboinflammation.
Biologie et signalisation des plaquettes en médecine personnalisée

Coordinateur : Bernard PAYRASTRE, Agnès RIBES, Fanny VARDON-BOUNES, Sophie VOISIN
Ce projet a pour but de développer la recherche translationnelle en lien avec le centre national des pathologies plaquettaires (CRPP) et les services cliniques du CHU de Toulouse. Nous mettons à profit notre expertise pour étudier les bases moléculaires des pathologies plaquettaires avec l’implémentation de nouvelles approches et méthodes de diagnostic pour une meilleure prise en charge des patients.
publications
PI3KC2β depletion rescues endosomal trafficking defects in Mtm1 knockout skeletal muscle cells.
MTM1-mediated production of phosphatidylinositol 5-phosphate fuels the formation of podosome-like protrusions regulating myoblast fusion.
PIKfyve-Dependent Phosphoinositide Dynamics in Megakaryocyte/Platelet Granule Integrity and Platelet Functions. Caux M, Mansour R, Xuereb JM, Chicanne G, Viaud J, Vauclard A, Boal F, Payrastre B, Tronchère H, Severin S. Arterioscler Thromb Vasc Biol. 2022. Pubmed
Platelet activation and partial desensitization are associated with viral xenophagy in patients with severe COVID-19.
Garcia C, Au Duong J, Poëtte M, Ribes A, Payre B, Mémier V, Sié P, Minville V, Voisin S, Payrastre B, Vardon-Bounes F. Blood Adv. 2022. Pubmed
PI3KC2β inactivation stabilizes VE-cadherin junctions and preserves vascular integrity.
Anquetyl T, Solinhac R, Jaffre A, Chicanne G, Viaud J, Darcourt J, Orset C, Göb E, Kleinschnitz C, Vanhaesebroeck B, Vivien D, Hnia K, Larrue V, Payrastre B, Gratacap MP. EMBO Reports 2021. Pubmed
Adipocyte fatty acid transfer supports megakaryocyte maturation.
Valet C, Batut A, Vauclard A, Dortignac A, Bellio M, Payrastre B, Valet P, Severin S. Cell Reports 2020. Pubmed
Catalytic dysregulation of SHP2 leading to Noonan syndromes impacts on platelet signaling and functions.
Bellio M, Garcia C, Edouard T, Voisin S, Neel B, Cabou C, Valet P, Mori J, Mazharian A, Senis Y, Yart A, Payrastre B, Severin S. Blood 2019. Pubmed
ILS NOUS SOUTIENNENT








Inserm/UPS UMR 1297 - I2MC Institut des Maladies Métaboliques et Cardiovasculaires
1 avenue Jean Poulhès - BP 84225 - 31432 Toulouse Cedex 4
Tél. : 05 61 32 56 00
Horaires
Du lundi au vendredi
8h30 - 12h30 / 13h45 -16h45